BCL-2抗凋亡蛋白过表达能够使得肿瘤细胞避免凋亡从而持续存活,包括CLL/SLL、MM、WM在内的血液系统恶性肿瘤(HMs)会有BCL-2高表达 1。目前被批准的BCL-2抑制剂(BCL-2i)——Venetoclax,尽管在某些血液肿瘤中证实有效,但需要长达5周的逐渐加量(Ramp-up)至目标剂量来避免发生肿瘤溶解综合征(TLS)。此外,该药还有出现严重粒缺乏的报道 2。Lisaftoclax(APG-2575)是我国研发的新型有潜力的口服选择性BCL-2i。2020年开始首次在中国进行I期临床试验,现已获得美国、澳大利亚多项Ib/II期临床试验许可,在全球范围内推进包括r/r CLL/SLL、WM、AML等多个血液肿瘤适应症的临床研究。
入组患者为:r/r CLL/SLL、HMs(MM,WM,NHL)及造血、肾功能正常患者;排除既往接受BCL-2i治疗;一年内接受Allo-HSCT、Burkitt、Burkitt-like淋巴瘤以及LBL/ALL;需要接受同时的中枢神经系统治疗的患者。Lisaftoclax采用每日口服1次,28天为1周期。采用标准的“3+3剂量爬坡”设计,剂量范围为:20~1200 mg/d,分为两个队列(图1)。
1) 队列A:对于non-CLL/SLL和发生TLS低风险患者,不再经过既往BCL-2i治疗中常用的“Ramp-up”逐步增量方法,直接给予目标剂量。
2) 队列B:对于CLL/SLL或发生TLS中/高风险患者,采用每日“Ramp-up”递增至目标剂量。

图1. Lisaftoclax (APG-2575)试验设计
共入组36例患者,诊断包括r/r CLL/SLL (n = 15)、MM (n = 6)、WM/LPL (n = 5)、FL (n = 5)、以及MCL、DLBCL、AML、MDS和HCL各1例。中位治疗6周期,爬坡至最大预定剂量1200 mg/d仍未达到MTD。未观察到DLT、实验室及临床TLS。常见的不良反应(> 10%患者的任何级别TRAE)包括:疲乏(27.8%)、中性粒细胞减少(22.2%)、及腹泻(19.4%)和贫血(16.7%)等。3-4级中性粒细胞减少的发生率为13.9%。在800mg/d及以上剂量组,发生3-4级TRAE也不常见。全部患者中只有1例患者因TRAE(2级皮疹)行药物减量(图2)。

图2. 治疗相关不良反应
在15例r/r CLL/SLL患者中,全部伴有至少一项“del(17p)/TP53、del(11q)、CD38+、IGHV野生型”不良预后特征。中位治疗9周期,ORR为80%(12/15)。Non-CLL/SLL患者21例,ORR为9.5%,但临床获益率可达50%。
初步PK曲线显示药物暴露量随给药剂量(20~1200 mg)的提高而增加(平均半衰期:4-5 h)。在r/r CLL/SLL样本中进行BH3结构分析,Lisaftoclax可迅速引发BCL-2复合物的变化,与临床观察到的患者ALC的快速减少一致。在队列B组(高TLS风险),根据PK/PD参数推荐600 mg/qd作为RP2D(II期推荐剂量)。
患者对Lisaftoclax的耐受性良好,剂量爬坡至1200 mg/d未观察到TLS或DLT,MTD未达到。在r/r CLL/SLL患者中的ORR为80%。采用每日(代替每周)“Ramp-up”递增策略结果安全可控,提示更短的给药递增策略可能是兼具安全性和便捷性的选择。因此,Lisaftoclax是治疗r/r CLL/SLL和其他血液肿瘤中潜在的可选择的方案。
BCL-2靶点的药物研发应用之路充满曲折。BCL-2基因通过t (14;18) 染色体易位断点区域首次于1985年发现 3,但因研发难度较大,直到2007年才有BH3模拟物形式的BCL-2i——Navitoclax(ABT-263)开展人体临床试验,结果表明对CLL/SLL、MM、AML等血液肿瘤治疗的有效性,但因同时抑制BCL-XL(一种血小板寿命抗凋亡蛋白)而导致严重血小板减少,限制了其临床进一步应用4。
随后出现的Venetoclax(ABT-199)是选择性BCL-2抑制剂,与BCL- XL作用力较弱,血小板减低的情况少见 5。因其在CLL/SLL、WM等HMs中出色的抗肿瘤作用,快速获得FDA审批,也是目前唯一被FDA和NMPA批准的BCL-2i。但Venetoclax伴随显著疗效的同时,可能出现严重的不良反应TLS(分为临床症状性TLS及实验室指标TLS)。在最初的临床探索中,剂量爬坡初始阶段3例患者直接给予目标剂量(200 mg/d或100 mg/d),均出现临床症状性TLS,1例患者因此死亡 2。此后,BCL-2i类药物的临床实践中均采用“Ramp-up”策略预防TLS的发生,即由初始20 mg w1每周增加剂量1次剂量的方法,经过逐步递增的方式经过4-5周加至目标剂量(低TLS风险20mg, d1; 50mg,w1),使得TLS发生率大大降低(图3)6。但这种方式的缺点就是不能让患者快速暴露至有效剂量,逐步提高剂量的时间较长。
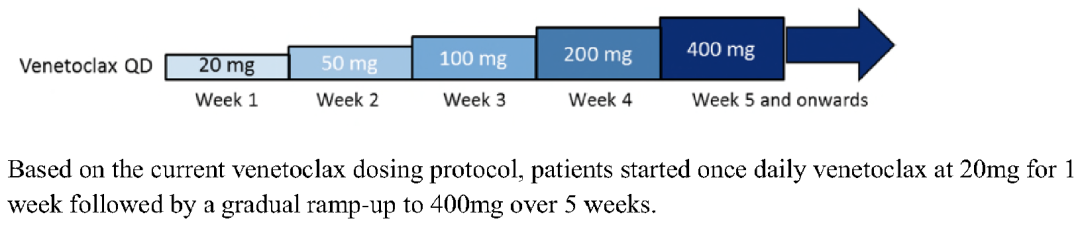
图3. Venetoclax等BCL-2i传统每周Ramp-up给药策略6
此次作为ASCO口头汇报的新型口服BCL-2i——Lisaftoclax (APG-2575),是首个进入临床阶段的国产BCL-2i。该研究治疗r/r CLL/SLL及HMs的临床试验设计突破了传统BCL-2i每周“Ramp-up”的方式。在r/r CLL/SLL及高危TLS中采用每日递增至目标剂量,并且在non-CLL及低危TLS发生人群中直接跳过此类药物中惯用的“Ramp-up”逐步递增剂量的方法。在36例接受治疗的患者中未观察到DLT以及TLS(包括实验室指标TLS),最高剂量1200 mg/d 仍未达MTD,显示出Lisaftoclax良好的安全性。研究设计表明了研究者对于Lisaftoclax安全性的信心,这也是BCL-2i等小分子药物给药策略发展趋势——结合疾病分型和TLS风险分级,缩短患者开始初始治疗至暴露至有效剂量的时间。尽管前景可期,但目前仍需用实验室TLS相关指标动态监测,为快速递增给药策略的提供给有力保障。
疗效方面,Lisaftoclax治疗r/r CLL/SLL与Venetoclax相比达到ORR方面相似,甚至可能更优(80% vs 65%-79%)2,说明Lisaftoclax在治疗r/r CLL/SLL的有效性值得肯定。但是疾病缓解的持续时间及深度仍是CLL/SLL关注重点指标。既往研究支持uMRD与CLL患者PFS延长相关 7,所以血液和骨髓MRD的深度缓解是CLL治疗的理想目标,我们更期待未来Lisaftoclax远期疗效数据的报道。
目前已有Venetoclax获批r/r CLL适应症,但BCL-2i在治疗该疾病上仍面临强劲对手。I/II期 TRANSEND CELL 004初步结果显示细胞治疗可能成为治愈r/r CLL/SLL的希望所在:高危r/r CLL患者接受liso-cel治疗ORR为82%,CR/CRi 45%,外周血uMRD可达75%,部分患者可获得快速持续深度缓解8。而Lisaftoclax作为少数全球在研的BCL-2i新型口服药物,承载BCL-2i药物发展延续的重大使命。尤其是面对快速迭代的新药时代,是否能带来潜在安全性优势,以及探索最适宜用药人群方面仍值得进一步探索。
但不能忽略的一点是:BCL-2i尽管在r/r CLL/SLL的疗效出色,在某些non-CLL/SLL的治疗效果仍不理想。该研究在non-CLL/SLL的其他HMs疗效结果较以往BCL-2i类药物一样似乎仍未有新突破,可能与某些肿瘤发生与凋亡诱导剂作用于Bcl-2下游、其他BCL-2家族蛋白过表达(例如BCL-XL、MCL-1),或依赖独立于Bcl-2的其它凋亡路径等导致的BCL-2i不敏感有关。本研究显示的Lisaftoclax治疗NHL的相关数据,可以视为后续探索更加合理的用药组合的新起点。Lisaftoclax在未来联合靶向、免疫、化疗甚至是细胞治疗等,探索协同抗肿瘤机制,或逆转前线药物耐药克隆,是未来BCL-2i突破其治疗局限性可能的方向。





 京公网安备 11010502033352号
京公网安备 11010502033352号