编者按:2020年美国癌症研究协会(AACR)会议更改为线上会议。此次会议中受人瞩目并可能会引发临床实践变革的研究有:卡马替尼治疗MET14号外显子跳跃突变非小细胞肺癌(NSCLC)的II期GEOMETRY mono-1研究——首个FDA批准的MET抑制剂用于治疗METex14晚期NSCLC,塞瑞替尼联合吉西他滨为基础的化疗治疗ALK/ROS1阳性晚期实体瘤I期临床研究——ALK抑制剂在非肺癌实体瘤中应用的探索,以及IL-1β抑制剂Canakinumab在早、晚期NSCLC中的CANOPY系列研究——首个促肿瘤炎症反应抑制剂治疗NSCLC探索。《肿瘤瞭望》小编将带您解读这几项研究的重点内容。
II期GEOMETRY mono-1研究——卡马替尼治疗MET14号外显子跳跃突变晚期NSCLC
研究背景:MET14号外显子跳跃突变(METex14)占NSCLC 约3-4%,与不良预后和治疗应答不佳有关。卡马替尼是一种高选择性、强效的MET受体酪氨酸激酶抑制剂。研究设计:GEOMETRY mono-1研究为多臂研究,分7个研究亚组,此次AACR会议中公布的为队列 4 和 5b的研究结果,队列4为经治患者,队列5b为初治患者。主要入组标准包括:IIIB/IV期NSCLC;METex14突变,不考虑MET 基因拷贝数(GCN)状态;EGFR(L858R和19del)野生型和ALK阴性;ECOG PS 0-1; ≥1个可测量病灶(RECIST 1.1标准);允许神经系统稳定或无症状脑转移。给予卡马替尼400 mg口服,一日两次。主要研究终点为总缓解率(ORR),次要研究终点为持续缓解时间(DOR)、无进展生存期(PFS)、总生存期(OS)以及安全性。
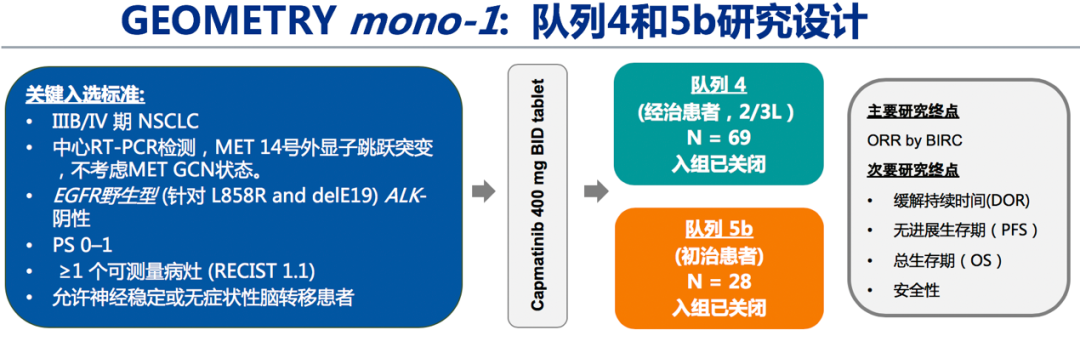
图1. GEOMETRY mono-1: 队列4和5b研究设计
1)总体疗效:BIRC评估的经治患者(队列4,n=69)和初治患者(队列5b,n=28)的ORR分别达 40.6%和67.9%,DCR分别为78.3%和96.4%。两个对列的大多数患者均观察到深度缓解。队列4/5b的中位DOC分别为9.72个月和11.14个月。BIRC评估与研究者评估结果一致。同时,两个队列均为快速和长期应答,大多数患者在治疗的前 7 周内出现应答:队列 4 为 82.1%,队列 5b 为 68.4%。
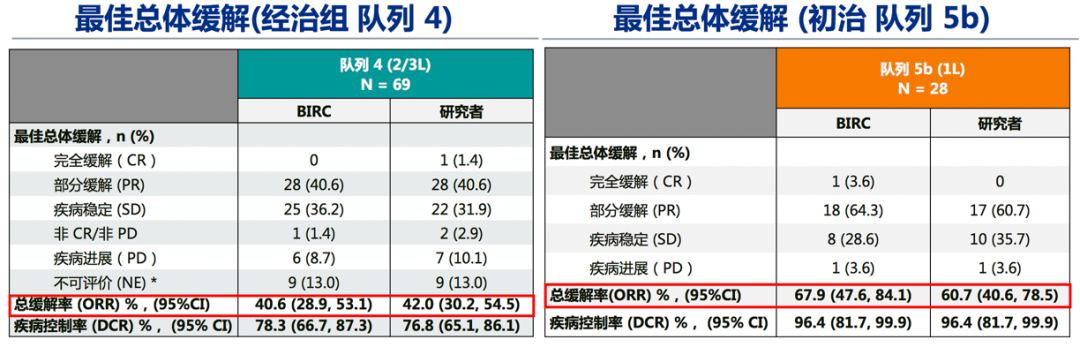
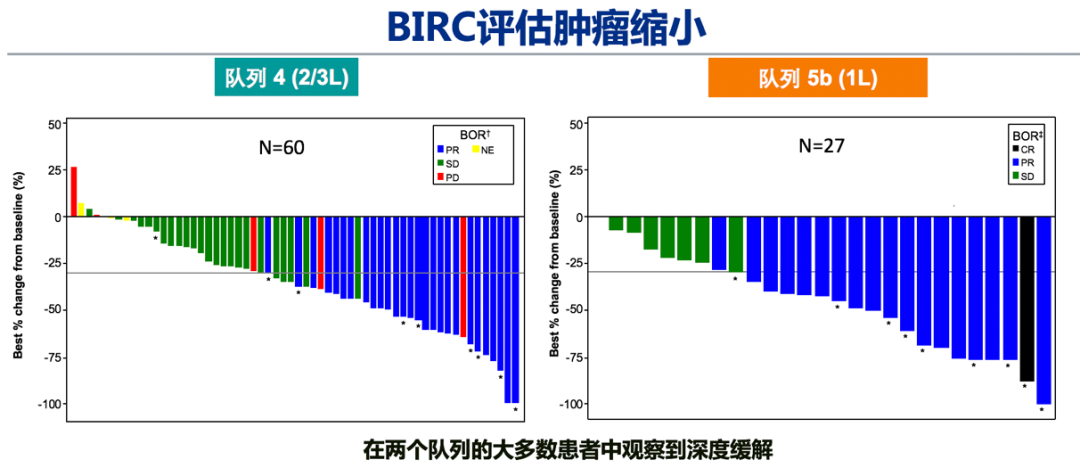
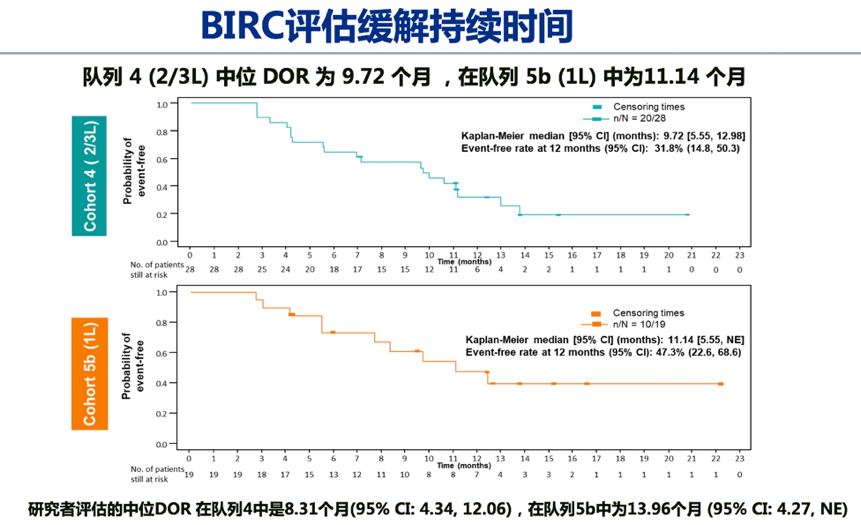
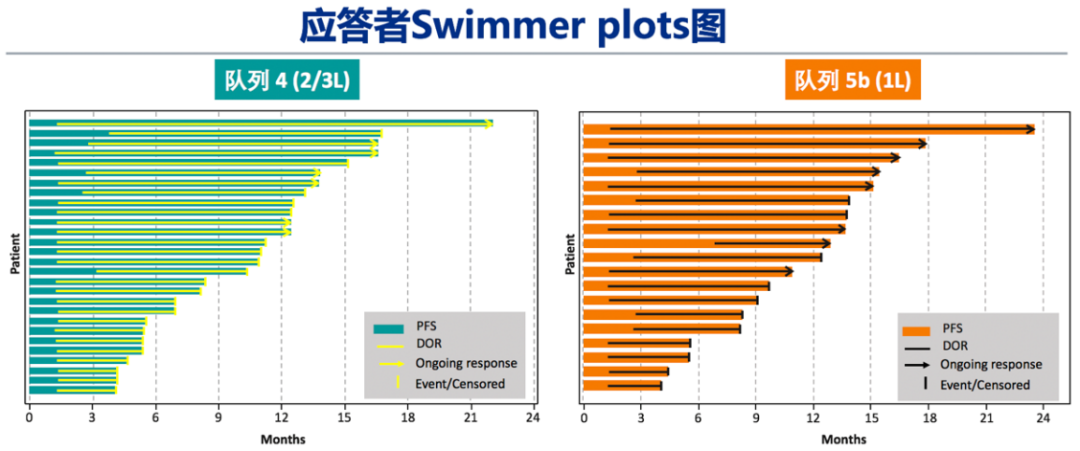
图2. GEOMETRY mono-1: 队列4和5b研究结果2)脑转移人群疗效:脑转移患者占队列4中15.9%(11例)、队列5b中10.7%(3例)。在13例可评价脑转移患者中,3 例为一线治疗,8 例为二线治疗,2例为三线治疗。基于BIRC 评估 54% (n=7/13)的患者出现颅内应答,这7例应答患者中,有3例既往接受过脑部放疗,5 例在研究入组时存在现有脑部病变进展或有新的脑转移的影响学证据。经卡马替尼治疗后,颅内应答7例患者中4 例患者的所有脑部病变完全消退。颅内应答和全身应答一样迅速,首次评价时(治疗开始后6 周),所有7 例应答患者均有颅内缓解。全部13例脑转移患者中92%(12/13)的患者实现颅内疾病控制。
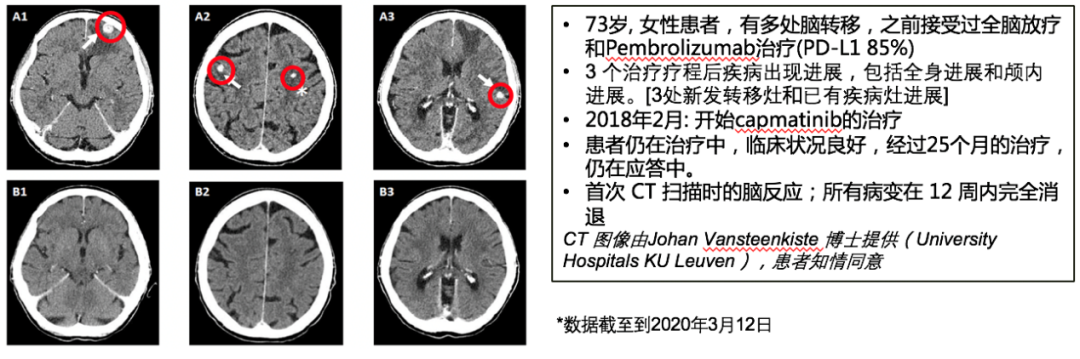
图3. GEOMETRY mono-1: 队列4和5b脑转移研究结果3)安全性:卡马替尼安全性良好、毒副作用整体可控。中位接受治疗时间约14.9周后,约有119例(35.6%)患者出现3/4级不良反应(AE),43例(12.9%)患者出现治疗相关的严重AE, 15例(4.5%)患者出现4级AE,73例(21.9%)患者因治疗相关AE引起的剂量调整,37例(11.1%)因治疗相关AE停药。常见AE(≥1%)为外周水肿(1.8%)、肺炎(1.5%)和疲乏(1.5%)。卡马替尼是一种强效的MET抑制剂,在METex14突变的晚期NSCLC患者中疗效显著、安全性可控。不论几线治疗,都有快速、深度、持续的应答,初治的METex14突变患者有更高的ORR,同时在脑转移患者中显示出初步疗效,后续研究可进一步验证。
ALK/ROS1阳性晚期实体瘤I期研究——塞瑞替尼联合吉西他滨为基础的化疗治疗ALK/ROS1阳性晚期实体瘤
研究背景:塞瑞替尼为口服、二代ALK/ROS1抑制剂,目前已批准治疗ALK重排NSCLC。实体瘤中也存在ALK/ROS1基因突变,胆管癌患者中约5%存在ALK过表达,37%存在ROS1表达,1-8%患者可检测到ROS1基因重排。基础研究显示胰腺上皮内瘤变(PanIN)和胰腺导管腺癌(PDAC)均有ALK表达,抗ALK单克隆抗体具有抗肿瘤增殖及转移性能。同时,ALK抑制剂与化疗药物有协同作用。因此,研究者设计了塞瑞替尼联合吉西他滨为基础的化疗方案治疗晚期实体肿瘤的I期临床试验。1)I期临床研究,剂量递增采用经典3+3爬坡设计。2)入组标准:可采用吉西他滨为基础治疗方案的晚期实体肿瘤;年龄>18周岁;ECOG PS 0-1;肝肾、骨髓功能正常;既往可使用ALK抑制剂。3)排除标准:接受过2线以上治疗(仅适用于Arm3);肺间质纤维化及间质性肺病;近期急性冠脉事件;慢性心功能不全,NYHA分级III/IV级;校正的QTc>450ms。4)分3个队列:Arm1: 吉西他滨1000 mg/m2,D1/8/15静脉注射, 28天为一周期;Arm2: 吉西他滨1000 mg/m2联合白蛋白紫杉醇100 mg/m2, D1/8/15静脉注射,28天为一周期;Arm3: 吉西他滨1000 mg/m2,D1/8,联合顺铂60 mg/m2,D1,静脉注射,21天为一周期。所有患者均口服塞瑞替尼(剂量水平1:450 mg/日;剂量水平2:600 mg/日)。5)研究终点:主要研究终点包括安全性、最大耐受剂量以及推荐的2期试验剂量。次要终点包括PK以及抗肿瘤效果,探索性研究目标为肿瘤标志物分析。6)相关伴随研究:PK采血在C1D1,CAD15以及C2D1三个时间点;可获得的肿瘤组织采用IHC方法检测ALK/ROS1/JNK/MET。研究结果:2015年1月至2018年11月,Roswell Park综合癌症中心共有38例患者入组。21例可评估剂量限制性毒性(DLT),15例受试者可评估有效性。Arm 2因毒性反应提前关闭入组,所有患者将于3月27日结束研究。Arm 1最大耐受剂量(MTD)为塞瑞替尼600 mg,Arm3组MTD为450 mg。治疗相关AE与单用化疗类似。有效性分析显示,总体ORR达20%,Arm1中1例头颈部肿瘤患者以及Arm3中1例原发部位不明患者取得PR,Arm3中1例胆管癌患者取得CR。总体DCR达60%,5例可评估胆管癌患者中3例有临床获益。
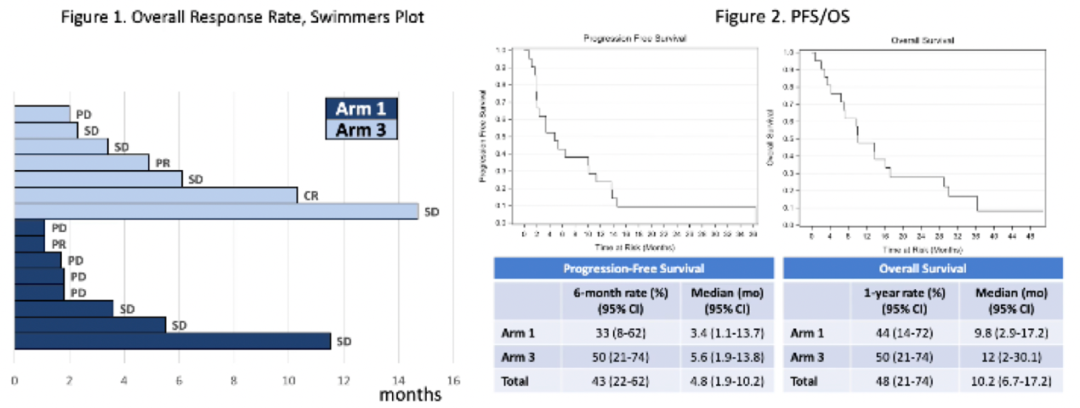
图4. 塞瑞替尼联合吉西他滨为基础的化疗治疗ALK/ROS1阳性晚期实体瘤研究结果药代动力学(PK)分析显示,塞瑞替尼各剂量组的中位AUC值无明显差异。与顺铂同用时,吉西他滨AUC明显降低。
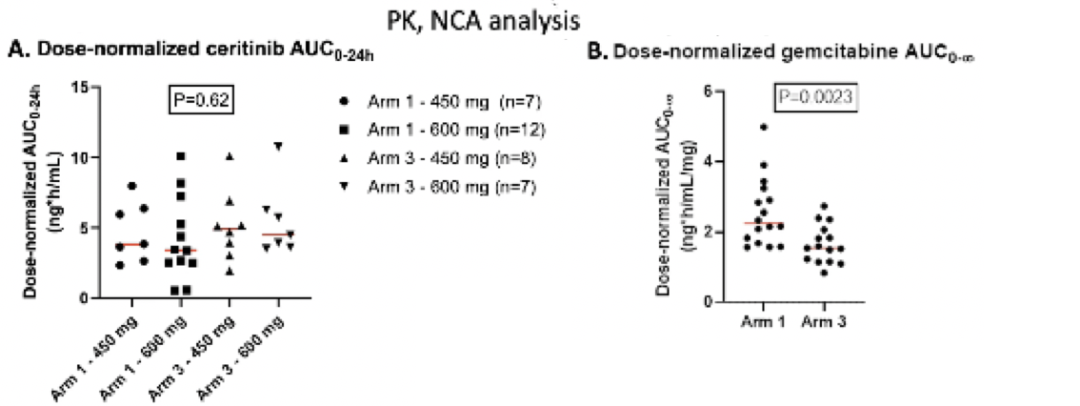
研究结论:塞瑞替尼和吉西他滨联合治疗时最大耐受剂量是600 mg/日,和吉西他滨/顺铂联合时最大耐受剂量为450 mg/日,毒副作用较化疗相比无明显增加,胆管癌中塞瑞替尼的初步疗效令人鼓舞,目前正在进行相关的生物标志物分析。PK分析提示,联合顺铂对塞瑞替尼PK无明显影响。本研究中的吉西他滨的清除率高于先前报道,可能和患者间吉西他滨PK差异大有关。
Canakinumab相关研究——Canakinumab治疗NSCLC
研究背景:Canakinumab是一种选择性的IL-1β抑制剂,可靶向肿瘤炎症反应并减少免疫抑制,从而增强免疫治疗效果。2017年发表在《新英格兰医学》杂志上的CANTOS研究意外地发现,针对心血管疾病的canakinumab可以大幅降低肺癌的发生率和死亡率。
图6. CANTOS研究结果
Canakinumab降低肺癌发病率(左)和死亡率(右)
来源:Lancet. 2017 Oct 21;390(10105):1833-1842.
Canakinumab目前正在开展的4项临床研究聚焦于肺癌领域,分别是用于晚期肺癌一线与帕博利珠单抗及化疗的联用研究(CANOPY-1);用于晚期肺癌二线免疫治疗进展后的联合化疗治疗(CANOPY-2);肺癌手术前的新辅助治疗(CANOPY-N)以及用于肺癌手术后的辅助治疗(CANOPY-A),研究对象均为没有EGFR或ALK突变的NSCLC患者。目前,CANOPY-1、CANOPY-2和CANOPY-A研究均在中国进行入组,其中前两项研究已经结束入组进入随访阶段。CANOPY-A研究还在中国多个中心入组辅助治疗后患者。感兴趣的医生朋友可以参考NMPA“药物临床试验登记与信息公示平台”。
CANOPY-1研究——Canakinumab±帕博利珠单抗+铂类为基础的化疗治疗初治晚期NSCLC的III 期临床研究
研究设计:多中心、随机双盲III期临床研究。研究入组标准:初治IIIB/IIIC和IV期NSCLC;PS评分0-1分;EGFR野生型和/或ALK阴性。该研究包括两个部分,第1部分是开放标签安全性导入部分,分为3个队列,每组约9例患者,用以确定III期研究中canakinumab方案的安全性。第2部分是III期随机双盲临床研究,纳入约600例患者,按1:1比例随机分配到研究组和对照组,两组患者均观察至疾病进展。
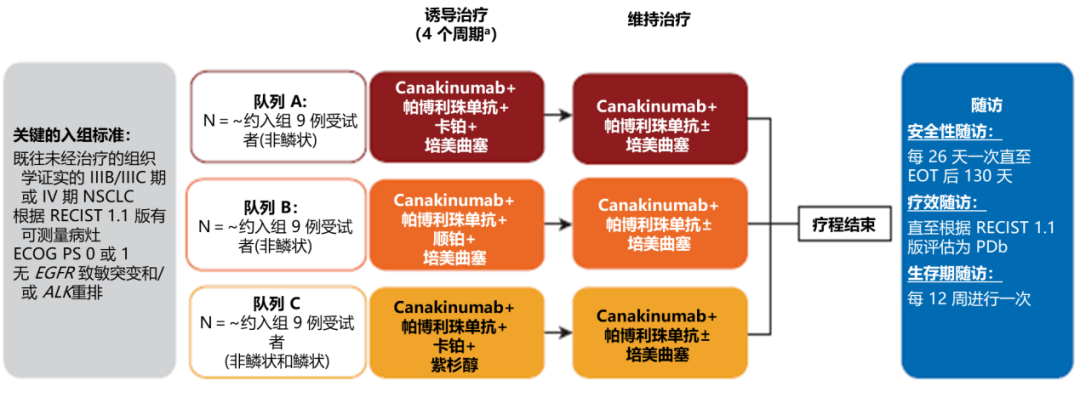
截至2019年5月14日,第1部分研究共计入组30例患者(队列A 10例,队列B 11例,队列C 9例)。在30名接受治疗的患者中,有6例患者(队列A 3例,队列B 2例,队列C 1例)中断了研究治疗,停药的主要原因是疾病进展(队列A 3例,队列B和C各1例)。在所有接受治疗的患者中,1例患者在开始治疗后的42天内出现DLT(队列C,3级肝炎,根据研究者评估,认为与帕博利珠单抗的使用相关)。根据BLRM和所有相关数据,canakinumab的III期临床研究推荐剂量被确认为200 mg每3周皮下注射联合帕博利珠单抗和铂类为基础的双药化疗。
所有药物减量的患者均来自队列C,肌痛(9名患者中1名)和周围神经病变(9名患者中2名)导致化疗减量;所有导致治疗中断的不良反应事件均为中性粒细胞数量减少(10%,3名患者),1例(3.3%)患者同时出现白细胞计数降低和和中性粒细胞减少症。由于不良反应事件导致治疗中断的患者共计3例(10%),均来自队列C,分别由于肝炎、周围神经病变和多发性神经病导致帕博利珠单抗和化疗中断,研究者认为与canakinumab无关。研究中未观察到5级不良反应事件。在所有不良反应事件中,最常见的的3级AE是肺栓塞(10%,3名患者,A、B和C队列各1例)和中性粒细胞减少症(10%,3名患者,A队列2例、队列C 1例),队列B中仅有1例患者报告4级AE(心脏填塞),共计8例患者(26.7%)出现严重的AE,研究者表示无一例与canakinumab相关。研究结论:Canakinumab联合帕博利珠单抗联合含铂双药化疗的总体安全性可控。所有的严重AE均和canakinumab不相关,也没有患者因为canakinumab而中断治疗。在所有患者中,43.3%的患者发生了3级AE,1例患者患者出现4级AE,未发生5级AE,常见(≥20%)的不良反应事件主要为恶心、呕吐、便秘、乏力和中性粒细胞减少,常见AE的治疗相对较为常见且易于控制,治疗效果较好。目前本研究第二部分三期随机临床试验部分已经结束入组,研究进入随访阶段。
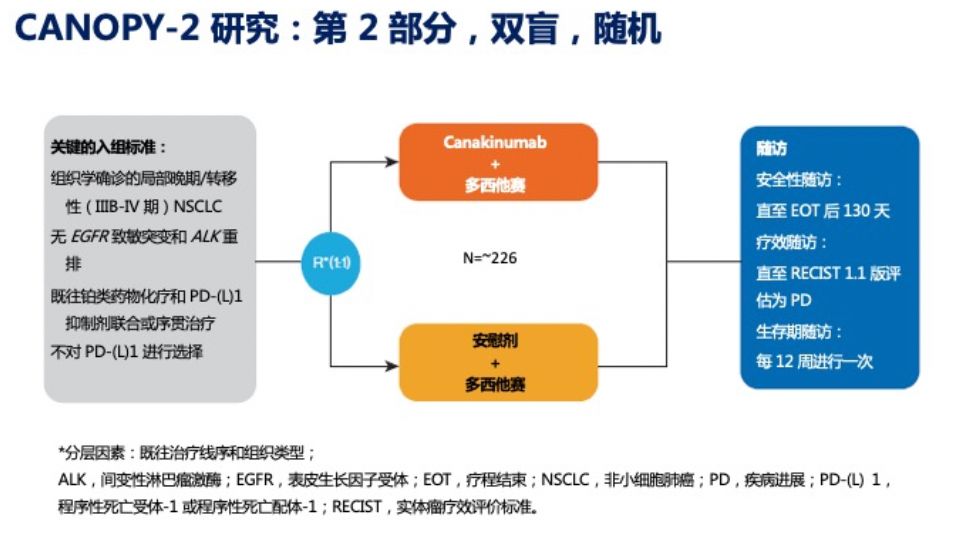
CANOPY-2研究——Canakinumab联合多西他赛对比安慰剂联合多西他赛在既往接受PD-L1/PD-1抑制剂和铂类化疗晚期NSCLC的III 期临床研究
研究意义:CANOPY-2研究针对的是无驱动基因晚期肺癌患者的二线用药,要求入组的患者之前已接受过PD-1抑制剂的一线治疗,这些患者对现有肿瘤免疫标准疗法都已产生耐药,除了接受化疗,无其他治疗手段可以选择。若CANOPY-2研究取得成功,则能为无驱动基因的二线或三线肺癌患者治疗提供更多选项,并为肿瘤免疫疗法耐药后的用药探索提供新的方向。研究设计:多中心、随机、双盲、安慰剂对照III期临床研究。研究组是Canakinumab+多西他赛,对照组是安慰剂+多西他赛,在既往接受过PD-1/L1抑制剂和铂类化疗的成人非小细胞患者中评估有效性和安全性。研究分两个部分:第1部分入组9例患者,评估方案的安全性;第2部分全球入组226例患者,其中中国25例,按1:1随机分配到试验组和对照组。目前本研究已经结束入组,研究进入随访阶段。
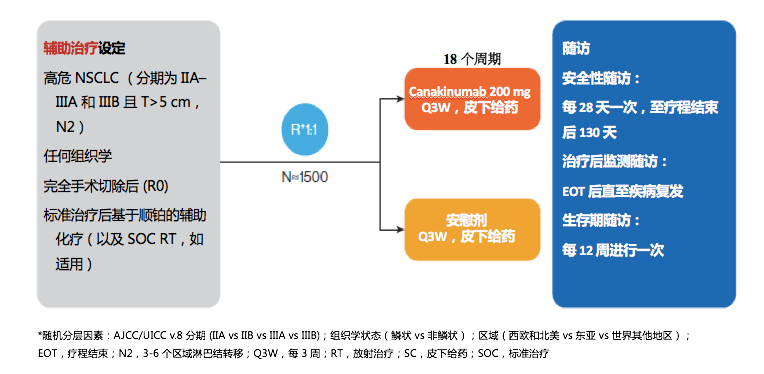
CANOPY-A研究——Canakinumab对比安慰剂作为早期肺癌患者的术后辅助治疗的有效性的III期临床试验
研究意义:CANOPY-A主要评价Canakinumab对比安慰剂作为辅助治疗对于手术后患者病情复发的影响。这一研究结果将最直接反应IL-1β靶点在调节肿瘤微环境、降低肿瘤的复发转移中的作用。研究设计:多中心、随机、双盲、安慰剂对照III期临床研究。入组标准:1)IIA-IIIA期和肿瘤直径>5 cm、N2的IIIB期高危术后NSCLC患者;2)任意组织学类型;3)完全性切除(R0);4)接受过术后标准含铂辅助化疗(和放疗)。随机分为两组,一组接受Canakinumab 200 mg/每3周治疗,另一组为安慰剂组。研究主要终点为DFS,次要终点为OS、肺癌特异性生存、安全性等指标,在研究中,还将探索性解析药代动力学、肿瘤突变负荷、炎症因子相关等。CANOPY-A研究正在中国多个中心入组辅助治疗后患者。
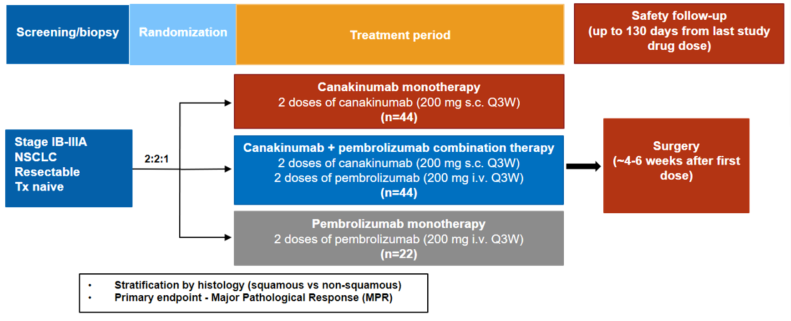
CANOPY-N研究——Canakinumab±帕博利珠单抗作为可切除NSCLC术前新辅助治疗的II期临床研究
研究意义:一些临床前研究以及临床研究结果显示,新辅助免疫治疗有可能成为高复发风险早期NSCLC患者治疗的标准治疗。CANOPY-N旨在探讨Canakinumab单用或联合帕博利珠单抗作为可切除NSCLC术前新辅助治疗的有效性。?研究设计:多中心、随机、开放标签、平行对照II期临床研究。入组标准:经组织学证实为IB-IIIA期NSCLC(AJCC第8版),除N2和T4外,适合手术切除;符合手术条件,计划(首次研究治疗后)约4-6周内进行手术切除;原发部位组织活检标本,若活检至研究治疗开始期间未接受过抗肿瘤治疗,可选取最多5个月内的活检保存标本;ECOG PS评分0-1。研究分3组:Canakinumab单药组、Canakinumab联合帕博利珠单抗组和帕博利珠单抗组。Canakinumab 200 mg/每3周治疗。研究主要终点为主要病理缓解(MPR)。
CANOPY系列研究总结:CANOPY系列研究涵盖了Canakinumab针对NSCLC从早期到晚期、从术前到术后、从一线到二线、从单药到联合的全方位临床研究,目前CANOPY-1研究已取得安全性数据结果,Canakinumab联合帕博利珠单抗联合含铂双药化疗的总体安全性可控,初步观察疗效较好,其他临床实验仍在入组阶段,研究结果令人期待。





 京公网安备 11010502033352号
京公网安备 11010502033352号